Ογκολογία στο νεογνό και στο βρέφος
Γράφει η
Ελένη Βασιλάτου-Κοσμίδη
Παιδίατρος, Αιματολόγος-Ογκολόγος, Διευθύντρια Ογκολογικής Κλινικής Παιδιών και Εφήβων Παίδων ΜΗΤΕΡΑ
Ο καρκίνος κατά την παιδική ηλικία είναι σπάνια νόσος και συνιστά <1% των περιπτώσεων καρκίνου στον άνθρωπο. Η ετήσια συχνότητα για παιδιά από τη γέννηση μέχρι την ηλικία των 14 χρόνων είναι 14 ανά 100.000 και για άτομα από 15-19 χρόνων είναι 20 ανά 100.000 (Steliarova-Foucher). O κίνδυνος ανάπτυξης καρκίνου από την γέννηση μέχρι την ηλικία των 20 χρόνων είναι 1:300 (Hubbard).
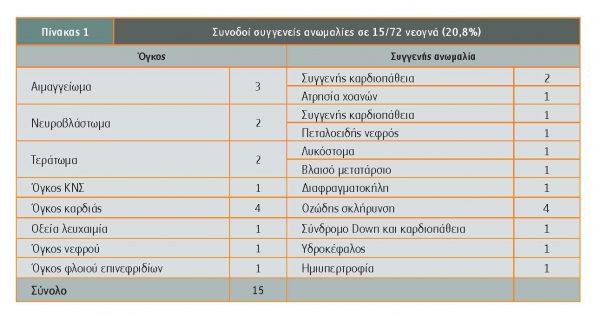
Μεταξύ των παιδιών και εφήβων που προσβάλλονται από καρκίνο, 1,5%-2% αφορούν την ηλικία από τη γέννηση έως 12 μηνών με συχνότητα από 1:12.500 – 1:27.500 γεννήσεις. Πριν από τη γέννηση, ορισμένοι όγκοι διαπιστώνονται κατά την εμβρυϊκή ζωή με τον συστηματικό έλεγχο της εγκύου μητέρας, οπότε διαγιγνώσκονται αμέσως μετά τη γέννηση ή κατά τη νεογνική περίοδο (εντός του πρώτου μήνα της ζωής) (Moore). Είναι ενδιαφέρον (πίνακας 1) ότι στο 15%-20,8% έχει παρατηρηθεί εμφάνιση όγκου παράλληλα με τη διαπίστωση διάφορων συγγενών ανωμαλιών (Berbel-Tornero).
Η ταχύτητα πολλαπλασιασμού των κυττάρων του εμβρύου κατά την εμβρυογένεση είναι τέτοια που θεωρείται μεγαλύτερη από τον πολλαπλασιασμό των κυττάρων όγκου ενηλίκων: “no adult tumor grows as rapidly as a normally dividing embryo”. Η εξέλιξη των κυττάρων του εμβρύου εμφανίζει ομοιότητες με την εξέλιξη των καρκινικών κυττάρων από πλευράς βιολογικής συμπεριφοράς: κυτταρική μετανάστευση, διήθηση, γονιδιακή έκφραση, διαφοροποίηση κυττάρων (Μa, Manzo). Αυτό συνεπάγεται αυξημένη μιτωτική δραστηριότητα των εμβρυονικών κυττάρων, η οποία, εφόσον συνεχίζεται, μπορεί να αποκτήσει “ογκόμορφη” όψη και μεγάλο μέγεθος λόγω απόφραξης αγγείων, πίεσης επί των αγγείων ή και λόγω ρήξης (Chandrasekaran, Marschall, Moore). Σε νεκροτομικό υλικό, σε 5%-17% διαπιστώνεται όγκος ή ογκόμορφη διεργασία (Hakverdi).
Στη βιβλιογραφία από μακρού έχει τεθεί το ερώτημα κατά πόσο οι μηχανισμοί τερατογένεσης και ογκογένεσης έχουν κοινή συνισταμένη και το πρώτο έτος της ζωής σχετικά με την εμφάνιση καρκίνου έχει αναφερθεί ως “ογκογόνος περίοδος χάριτος” (oncogenic period of grace), δεδομένου ότι στις ηλικίες αυτές έχει παρατηρηθεί το φαινόμενο της διαφοροποίησης με ή χωρίς αυτόματη υποστροφή του όγκου.
Καρκίνος στην έγκυο μητέρα
Σε σπάνιες περιπτώσεις, έχει αναφερθεί η παρουσία όγκου “μεταστατικού” από τη νοσούσα από καρκίνο έγκυο μητέρα μέσω του πλακούντα στο νεογνό. H συχνότητα διαπίστωσης καρκίνου κατά τη διάρκεια της εγκυμοσύνης έχει αυξηθεί από 112/100.000 το 1994 σε 191/100.000 το 2008 (Vandenbroucke), με συχνότερους τύπους διαπλακουντιακής μεταφοράς τον καρκίνο μαστού, τη λευχαιμία και το μελάνωμα. Είναι άξια αναφοράς η διάγνωση σε μητέρα λευχαιμίας bcr/abl θετικής (χρωμόσωμα Φιλαδελφείας – t(9;22)) την ημέρα 39 μετά τον τοκετό και η διαπίστωση του ίδιου (bcr/abl+) τύπου λευχαιμίας στο βρέφος τον 11ο μήνα της ζωής (Isoda). Αξίζει να σημειωθεί ότι, εάν κριθεί αναγκαία η χορήγηση χημειοθεραπείας στη μητέρα, απαιτείται ιδιαίτερη προσοχή, δεδομένου ότι δια μέσου του πλακούντα διέρχονται ορισμένα φάρμακα, όπως π.χ. παράγωγα της πλατίνας (50%), παράγωγα ανθρακυκλινών (<10%) και πολύ λιγότερο ταξάνες (<1%) (Hepner).
Ιδιαιτερότητες του καρκίνου σε νεογνά και βρέφη
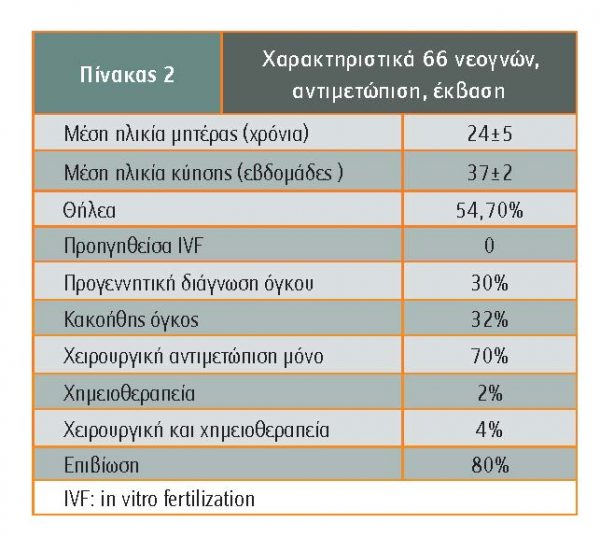
Σε μελέτη 66 νεογνών που εμφάνισαν κάποιο τύπο όγκου καρκίνου, η μητέρα ήταν <30 χρόνων, η ηλικία κύησης >35 εβδομάδες και ο όγκος στο 1/3 περίπου είχε διαγνωστεί προγεννητικά, όπως φαίνεται στον πίνακα 2 (Kadivar).
Τα αίτια που ευθύνονται για τη δημιουργία όγκων στα νεογνά και στα βρέφη είναι γενικά άγνωστα. Ως παράγοντες κινδύνου θεωρούνται γενετικές ανωμαλίες σε ποσοστό που ανέρχεται σε 4%-10% (όπως και στον καρκίνο σε μεγαλύτερα παιδιά), ενδομήτριες, περιβαλλοντογενείς, και διαπλακουντιακές αιτίες (Zapata-Tares). Η εξωσωματική γονιμοποίηση έχει ενοχοποιηθεί για σχετικά μικρή αύξηση επίπτωσης όγκων ήπατος σε παιδιά, όχι όμως ιδιαίτερα σε βρέφη (Spector). Πρόσφατη σχετικά μελέτη (Wickremasinghe) περιγράφει μικρή, αλλά στατιστικά σημαντική αύξηση καρκίνου (όγκος νεφρού, οξεία μυελογενής λευχαιμία) σε νεογνά που υποβλήθηκαν σε φωτοθεραπεία και συγκεκριμένα διαπιστώθηκε ένας επιπλέον καρκίνος ανά 10.500 βρέφη που υποβλήθηκαν σε φωτοθεραπεία.
Ύποπτα για όγκο ευρήματα στο υπερηχογράφημα εγκύου είναι η παρουσία μορφώματος κυστικού ή συμπαγούς, παρουσία αποτιτανώσεων, νεοαγγείωσης, αιμορραγίας, αλλά και η ύπαρξη πολυυδράμνιου. Το πολυυδράμνιο σχετίζεται με προβλήματα κατάποσης του εμβρύου (όγκοι ΚΝΣ), απόφραξης (όγκοι από το πεπτικό σύστημα) και υπερπαραγωγής αμνιακού υγρού (ιεροκοκκυγικό τεράτωμα) (Pilu, Cho).
Τύποι καρκίνου σε νεογνά και βρέφη
Α. Γενικά
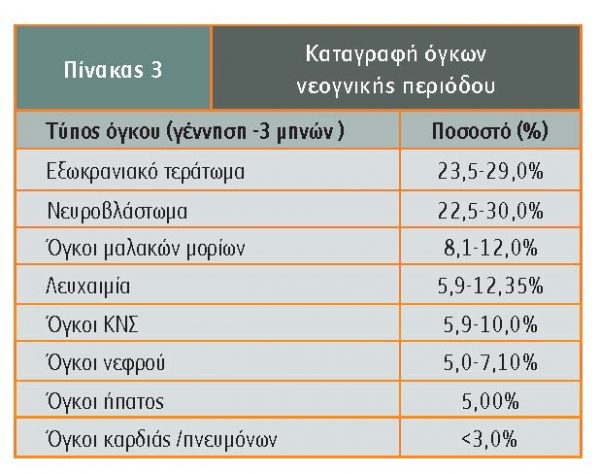
Σε σύστημα καταγραφής όγκων νεογνικής περιόδου (γέννηση μέχρι 3 μηνών) σε περίοδο 30 χρόνων καταγράφηκαν 170 όγκοι, μεταξύ των οποίων 21 λευχαιμίες, 14 όγκοι του ΚΝΣ και 135 διάφοροι συμπαγείς όγκοι. Όπως φαίνεται στον πίνακα 3, από αυτούς 58% καταγράφηκαν τον πρώτο μήνα ζωής και η συχνότερη διάγνωση (29%) ήταν ώριμο τεράτωμα (Parkes).
Συχνότεροι όγκοι στο νεογνό και ανάλογα με την εντόπισή τους αναφέρονται παρακάτω (Gow):
- ΚΝΣ: Τεράτωμα, αστροκύττωμα, όγκοι τύπου ΡΝΕΤ, ραβδοειδείς όγκοι, όγκοι χοριοειδούς πλέγματος. Στην τελευταία περίπτωση πρέπει να γίνει στο νεογνό έλεγχος του γονιδίου p53 για το σύνδρομο Li-Fraumeni και επί ανεύρεσης του γονιδίου πρέπει να ελεγχθεί όλη η οικογένεια.
- Κεφαλή-τράχηλος: Συγγενείς κύστεις, αιμαγγείωμα, λεμφαγγείωμα, τεράτωμα.
- Θώρακας: Τεράτωμα, ραβδομύωμα καρδιάς (έλεγχος για οζώδη σκλήρυνση), νευρογενείς όγκοι, κυστικές βλάβες πνεύμονα.
- Κοιλιά και πύελος: Αιμαγγείωμα ή λεμφαγγείωμα ήπατος, μεσοβλαστικό νέφρωμα, νευροβλάστωμα, τεράτωμα.
- Άκρα και μαλακά μόρια: Αιμαγγείωμα, λίπωμα, ινοβλαστικοί όγκοι, ινοσάρκωμα, ραβδομυοσάρκωμα.
Όπως σε κάθε ηλικία και για κάθε τύπο καρκίνου, σημαντικοί προγνωστικοί παράγοντες είναι η ιστολογία του όγκου, η εντόπιση και η παρουσία ή μη μεταστάσεων. Σε όγκους και γενικά σε καρκίνο που διαπιστώνεται στη νεογνική και βρεφική ηλικία, η βιολογική συμπεριφορά ποικίλλει από πολύ καλή (ακόμη και χωρίς θεραπευτική παρέμβαση, π.χ. στο νευροβλάστωμα) έως πολύ επιφυλακτική (βρεφική λευχαιμία) (Woodward).
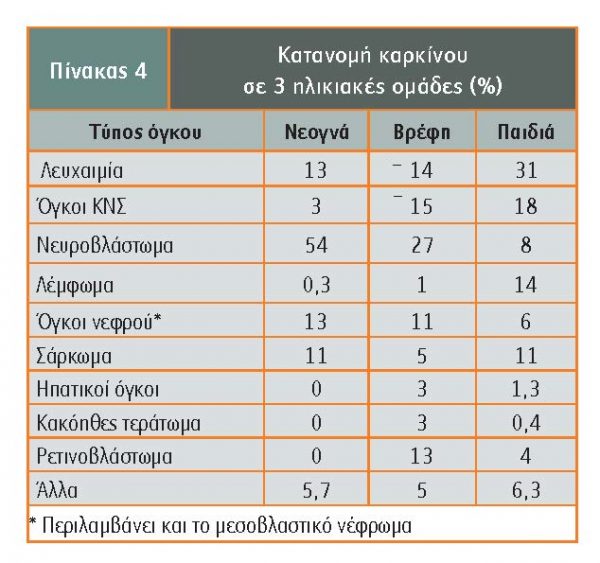
Η συχνότητα ανάπτυξης διάφορων τύπων καρκίνου στις 3 ηλικιακές ομάδες νεογνών, βρεφών και μεγαλύτερων παιδιών, ποικίλλει (Kosmidis). Στον πίνακα 4 εμφανίζεται η αυξημένη συχνότητα νευροβλαστώματος στα νεογνά και βρέφη και λευχαιμίας στα μεγαλύτερα παιδιά, ενώ είναι περίπου ίδια η συχνότητα όγκων του ΚΝΣ σε βρέφη και μεγαλύτερα παιδιά.
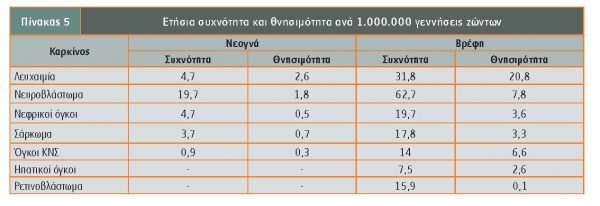
Στον πίνακα 5 παρουσιάζεται η ετήσια συχνότητα και θνησιμότητα από καρκίνο ανά 1.000.000 γεννήσεις ζώντων (Βασιλάτου-Κοσμίδη).
Β. Ειδικοί τύποι καρκίνου
Ι. Λευχαιμία
- Συγγενής λευχαιμία: Όταν η λευχαιμία διαγιγνώσκεται τις πρώτες 4 εβδομάδες μετά τη γέννηση, ονομάζεται συγγενής λευχαιμία και συνιστά <1% των λευχαιμιών στην παιδική ηλικία με επίπτωση 1 ανά 5.000.000 γεννήσεις. Στην πλειονότητα (64%) πρόκειται για οξεία μυελογενή λευχαιμία, που κατά τη διάγνωση έχει υπερλευκοκυττάρωση, οργανομεγαλία και αναπνευστική δυσπραγία, με ή χωρίς συνύπαρξη ύδρωπα. Σε 25%-30% εμφανίζονται εκδηλώσεις από το δέρμα (leukemia cutis) που μπορεί σε 10% των περιπτώσεων να είναι η μόνη εκδήλωση, ενώ σε 50% συνυπάρχει με τα υπόλοιπα κλινικά ή και εργαστηριακά ευρήματα της λευχαιμίας. Στη συγγενή λευχαιμία διαπιστώνεται αναδιάταξη του γονιδίου ΚΜΤ2Α (MLL) στη θέση 11q23 και η πρόγνωση είναι πολύ κακή (Tewari).
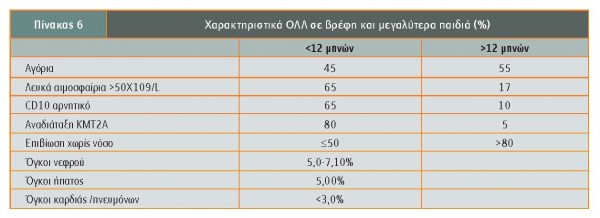
- Βρεφική λευχαιμία: H βρεφική λευχαιμία (διάγνωση μετά τον πρώτο μήνα και έως τον 12ο μήνα της ζωής) είναι επίσης σπάνια, με επίπτωση 41 ανά 1.000.000 βρέφη. Η συχνότητα της οξείας λεμφοβλαστικής λευχαιμίας (ΟΛΛ) στα βρέφη είναι μικρότερη από εκείνη σε παιδιά 1-14 χρόνων και ίση με εκείνη σε εφήβους, η λευχαιμία είναι συχνότερα Β προέλευσης και προσβάλλει περισσότερο κορίτσια, ενώ η συχνότητα της οξείας μυελογενούς λευχαιμίας στα βρέφη είναι διπλάσια από τη συχνότητα σε μεγαλύτερα παιδιά και εφήβους Στα βρέφη με ΟΛΛ η παρουσία χρωμοσωμικών μεταθέσεων μεταξύ του γονιδίου ΚΜΤ2Α στη θέση 11q23 (προηγούμενη ονομασία MLL -mixed lineage leukemia) και άλλων γονιδίων, μεταξύ των οποίων το συχνότερο (περίπου 50%) είναι το ΑFF1 (προηγούμενη ονομασία AF4), είναι συχνή (70%-80%) σε αντίθεση με τα μεγαλύτερα παιδιά, στα οποία η αναδιάταξη του γονιδίου ΚΜΤ2Α είναι μόλις 5%). Ηλικία <6 μηνών (σε αμερικανικά πρωτόκολλα <3 μηνών), αριθμός λευκών αιμοσφαιρίων >300.000 και αναδιάταξη του γονιδίου ΚΜΤ2Α-r έχουν ακόμη χειρότερη πρόγνωση (Brown). Μελέτη των νεογνικών καρτών Guthrie έχει δείξει την παρουσία συγχώνευσης γονιδίων όπως το ETV6/RUNX1 (παλαιά ονομασία ΤΕL/AML1) ήδη κατά τη γέννηση, χωρίς απαραίτητα τα νεογνά αυτά να εμφανίσουν στο μέλλον λευχαιμία, σε αντίθεση με τη συγχώνευση του γονιδίου ΚΜΤ2Α π.χ. με το ΑFF1, που οδηγεί σε σχετικά σύντομο χρόνο σε ανάπτυξη βρεφικής ΟΛΛ (Greaves). Όπως και στη συγγενή λευχαιμία και παρά τον σχεδιασμό και χρησιμοποίηση πρωτοκόλλων χρησιμοποιούμενων στη βρεφική ηλικία, η πρόγνωση εξακολουθεί να υπολείπεται από εκείνη της ΟΛΛ σε μεγαλύτερα παιδιά. Επίσης ανοσοφαινοτυπικά πρόκειται για άωρη ΟΛΛ συχνά CD10 αρνητική, σε αντίθεση με τα μεγαλύτερα παιδιά. Στον πίνακα 6 αναφέρονται τα χαρακτηριστικά και οι διαφορές της ΟΛΛ σε βρέφη και μεγαλύτερα παιδιά (Kosmidis).
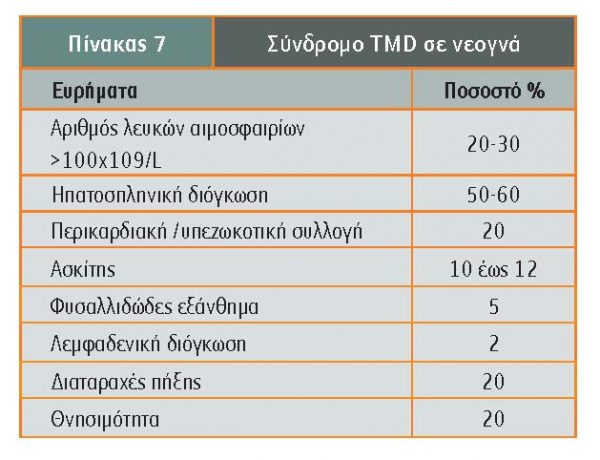
- Παροδική μυελοϋπερπλαστική νόσος: Σε ποσοστό 5%-10% των νεογνών με σύνδρομο Down έχει παρατηρηθεί η ονομαζόμενη παροδική μυελοϋπερπλαστική νόσος (transient myeloproliferative disease-TMD), η οποία αρχίζει κατά την ενδομήτριο ζωή και οδηγεί στην παροδική παρουσία βλαστών μεγακαρυοβλαστικής προέλευσης. Σε παιδιά με τρισωμία 21 οι προβαθμίδες της μεγακαρυοκυτταρικής και της ερυθράς σειράς πολλαπλασιάζονται στο εμβρυικό ήπαρ και, μέσω μετάλλαξης του μεταγραφικού αιμοποιητικού παράγοντα GATA1, προκαλείται παθολογική διαφοροποίηση μεγακαρυοκυττάρων και παρουσία βλαστών. Χαρακτηριστική είναι η παρουσία μεγαλύτερου ποσοστού βλαστών στο περιφερικό αίμα σε σχέση με το ποσοστό βλαστών στον μυελό των οστών, παρατήρηση που επιβεβαιώνει την προέλευση των βλαστών από κύτταρα εμβρυϊκής αιμοποίησης όπως το ήπαρ. Στην πλειονότητα των νεογνών η μυελοϋπερπλαστική αυτή κατάσταση υποχωρεί εντός των 3 πρώτων μηνών ζωής, ωστόσο στο 20% περίπου των νεογνών εξελίσσεται σε οξεία μυελογενή λευχαιμία (GATA1 θετική οξεία μεγακαρυοβλαστική λευχαιμία -Μ7) εντός των 4 πρώτων χρόνων της ζωής. Επίσης, 15%-20% των νεογνών με ηπατομεγαλία είναι δυνατόν να εμφανίσουν ηπατική ίνωση (Gamis, Hitzler). Τα κλινικοεργαστηριακά ευρήματα του συνδρόμου της παροδικής μυελοϋπερπλαστικής νόσου των νεογνών με σύνδρομο Down περιγράφονται στον πίνακα 7.
ΙΙ. Νευροβλάστωμα
Μεταξύ των νεοπλασμάτων που διαπιστώνονται στα νεογνά και στα βρέφη (εφόσον εξαιρεθούν τα αγγειακής προέλευσης μορφώματα και το τεράτωμα), συχνότερος όγκος είναι το νευροβλάστωμα, που συνιστά το 20%-50% των όγκων κατά την περίοδο αυτή. Η συχνότερη εντόπιση είναι τα επινεφρίδια και ακολουθεί η παρασπονδυλική περιοχή. Οι όγκοι είναι συνήθως μικροί σε μέγεθος και σε ορισμένες περιπτώσεις έχουν εντοπιστεί κατά τον προγεννητικό έλεγχο. Σε πολλούς προγεννητικά διαπιστωμένους όγκους παρατηρείται αυτόματη υποστροφή.
Σπανίως οι όγκοι αυτοί είναι μεταστατικοί, εκτός αν πρόκειται για ορισμένα βρέφη (ή και μεγαλύτερα παιδιά ηλικίας μέχρι και 18 μηνών) στα οποία η νόσος μπορεί να εμφανίζει μεταστάσεις στο δέρμα, στο ήπαρ, στον μυελό των οστών, με διήθηση <10%. Ο πρωτοπαθής όγκος δεν περνά τη μέση γραμμή, τοπικά είναι σταδίου 1 ή 2 και δεν υπάρχουν οστικές μεταστάσεις σε απλή ακτινογραφία οστών, έστω κι αν στο σπινθηρογράφημα επινεφριδίων (MIBG) ή οστών με τεχνήτιο υπάρχει πρόσληψη. Ο όγκος τότε θεωρείται σταδίου Ms (παλαιότερος όρος 4s) και η πρόγνωση είναι πολύ καλή, με την προϋπόθεση ότι ο όγκος δεν φέρει αρνητικούς μοριακούς δείκτες (ενίσχυση MYCN, 1p del, 11q del, 17q gain) (Taggart, Zhang).
Ιδιαίτερη αναφορά πρέπει να γίνει στις επινεφριδιακές μάζες που έχουν διαγνωστεί είτε προγεννητικά ή μετά τη γέννηση και μέχρι την ηλικία των 90 ημερών. Στην περίπτωση αυτή και εφόσον ο όγκος είναι <5 cm, προτείνεται παρακολούθηση με υπερηχογράφημα κοιλίας και μέτρηση κατεχολαμινών ούρων. Μυελόγραμμα και σπινθηρογράφημα επινεφριδίων συνιστάται μετά την ηλικία των 3 μηνών (Low and intermediate risk Neuroblastoma guidelines CCLG, 2020).
ΙΙΙ. Τεράτωμα
Ο συχνότερος τύπος εξωγοναδικού τερατώματος κατά τη γέννηση είναι το ιεροκοκκυγικό, με συχνότητα 1/40.000 γεννήσεις. Σε 70% προσβάλλει κορίτσια, συχνά η διάγνωση έχει τεθεί πριν από τη γέννηση (παρουσία του όγκου με συνοδό πολυυδράμνιο) και σε 50% πρόκειται για ώριμο τεράτωμα τύπου Ι, δηλαδή ο όγκος είναι εξωφυτικός. Τύπου ΙΙ είναι όγκοι με εξωφυτική και ενδοπυελική συνισταμένη, τύπου ΙΙΙ ως επί τύπου ΙΙ με επιπλέον ενδοκοιλιακό μέρος και τύπου ΙV όγκοι με ενδοπυελική εντόπιση μόνο (<10%). Στα νεογνά αυτά η α1 εμβρυϊκή σφαιρίνη (άλφα φετοπρωτεΐνη) είναι αυξημένη περισσότερο από τα αναμενόμενα για την ηλικία επίπεδα. Άλλες εντοπίσεις λιγότερο συχνές στην ηλικία αυτή είναι η περιοχή κεφαλής ή τραχήλου, ενώ οι γοναδικοί όγκοι είναι σπάνιοι (Bhat).
- Συγγενές μεσοβλαστικό νέφρωμα
Ο συχνότερος όγκος νεφρού στη νεογνική ηλικία και μέχρι τους 3 πρώτους μήνες της ζωής είναι το συγγενές μεσοβλαστικό νέφρωμα, που ενδέχεται να διαγνωστεί προγεννητικά (Khashu,Wang). Ο όγκος είναι συχνότερα σταδίου Ι ή ΙΙ και είναι σπάνια μεταστατικός. Έχουν περιγραφεί 3 ιστολογικοί υπότυποι (ο κυτταρικός, ο κλασικός και ο μικτός) και θεραπευτικά αντιμετωπίζεται με νεφρεκτομή μόνο. Στον όγκο αυτό έχουν διαπιστωθεί δύο μοριακές ανωμαλίες: τρισωμία 11 και μετάθεση t(12;15)(p13q25) (Gooskens).
- Όγκοι ΚΝΣ
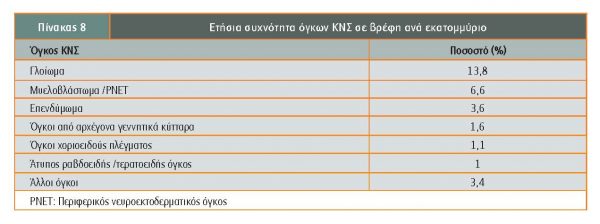
Οι όγκοι ΚΝΣ που διαγιγνώσκονται σε βρέφη, συνιστούν το 10% των όγκων ΚΝΣ που παρατηρούνται στην παιδική ηλικία και σε 50% αφορούν βρέφη <6 μηνών. Σε 65% οι όγκοι έχουν υπερσκηνιδιακή εντόπιση και ο συχνότερος ιστολογικός υπότυπος είναι το γλοίωμα (42,5%). Η χρήση της ακτινοθεραπείας ως θεραπευτικής επιλογής, λόγω της συχνά καταστροφικής συνέπειας στον αναπτυσσόμενο εγκέφαλο του βρέφους, πρέπει να αποφασίζεται με ιδιαίτερη σύνεση. Στον πίνακα 8 αναφέρεται η συχνότητα ανά εκατομμύριο (Bishop, Chedkar).
Από τους παραπάνω όγκους ΚΝΣ ιδιαίτερη αναφορά πρέπει να γίνει στα βρέφη με όγκο χοριοειδούς πλέγματος, τα οποία πρέπει να ελεγχθούν για τη μετάλλαξη p53 που παρατηρείται στο σύνδρομο οικογενούς καρκίνου Li-Fraumeni (Orr).
- Σπάνιοι όγκοι
Άλλοι σπανιότεροι όγκοι είναι το βρεφικό ινοσάρκωμα, η επιθετική ινωμάτωση, οι δεσμοειδείς όγκοι, το ραβδομύωμα καρδιάς και το αγγειομυολίπωμα νεφρού (έλεγχος για οζώδη σκλήρυνση), το ρετινοβλάστωμα (λήψη οικογενειακού ιστορικού), η ιστιοκυττάρωση Langerhans και συγκεκριμένα η στο παρελθόν ονομαζόμενη Letterer -Siwe, στην οποία διαπιστώνονται δερματικές βλάβες, ωτόρροια, οστεολύσεις, ηπατοσπληνομεγαλία, λεμφαδενικές διογκώσεις, διήθηση μυελού των οστών και η πρόγνωση είναι επιφυλακτική.
Αγγειακές ανωμαλίες
H Διεθνής Εταιρεία Μελέτης των Αγγειακών Ανωμαλιών (International Society for Study of Vascular Anomalies (ISSVA) κατατάσσει τις αγγειακές ανωμαλίες σε 3 ομάδες: καλοήθεις, οριακά κακοήθεις και κακοήθεις (πίνακας 9). Στα νεογνά και στα βρέφη συνήθως διαπιστώνονται καλοήθεις ανωμαλίες (Wildgruber).
Τα αιμαγγειώματα μπορεί να εντοπίζονται στο δέρμα ή σε διάφορα όργανα, όπως το ήπαρ ή ο εγκέφαλος. Εκτεταμένα αιμαγγειώματα είναι δυνατόν να συνοδεύονται από το φαινόμενο Kasabach-Meritt με εκδηλώσεις αιμορραγίας λόγω θρομβοπενίας και κατανάλωσης παραγόντων πήξης. Τα βρεφικά αιμαγγειώματα του δέρματος εντοπίζονται στις ανατομικές περιοχές κεφαλής -τραχήλου (60%), κορμού (25%) ή άκρων (15%).
Εκτός από αιμαγγειώματα, στα βρέφη παρατηρούνται λεμφαγγειώματα, π.χ. κυστικό ύγρωμα και αμαρτώματα, με κύριες εντοπίσεις τον υποθάλαμο, τους πνεύμονες, το δέρμα και το ήπαρ.
Δερματικές εκδηλώσεις
To δέρμα του νεογνού και του βρέφους είναι δυνατόν να οδηγήσει στη διάγνωση συστηματικών νοσημάτων. Στα νεογνά, επί παρουσίας δερματικών βλαβών του τύπου blueberry muffin η διαφορική διάγνωση πρέπει να περιλαμβάνει συγγενείς λοιμώξεις (ΤΟRCH), αιμόλυση, αγγειακές βλάβες και διάφορα ογκολογικά νοσήματα όπως φαίνεται στον πίνακα 10 (Mondi).

Συμπεράσματα
Η εμφάνιση ογκόμορφης διεργασίας, όγκου καλοήθους ή κακοήθους και οποιουδήποτε τύπου καρκίνου σε νεογνά και βρέφη σηματοδοτεί άγχος, δικαιολογημένη ανησυχία, υπέρμετρη ευαισθησία τόσο στους γονείς όσο και στους θεράποντες γιατρούς. Σε ένα μεγάλο ποσοστό (30%) ιδιαίτερα σε όγκους νευρογενούς προέλευσης, η διάγνωση ή η υποψία της διάγνωσης τίθεται προγεννητικά. Σε 15%-20% συνυπάρχουν διάφορες συγγενείς ανωμαλίες και εντοπίζονται κυρίως στην περιοχή κεφαλής και τραχήλου (26%) και κοιλιάς (19%).
Συχνά τα όρια μεταξύ αμιγούς κακοήθους όγκου και καλοήθους νεοπλασίας δεν είναι διακριτά, ενώ σε ορισμένους όγκους όπως το νευροβλάστωμα, έχει διαπιστωθεί αυτόματη υποστροφή.
Σε ορισμένες κατηγορίες όγκων (π.χ. συγγενείς επινεφριδιακές μάζες <5 cm) ή καταστάσεων, όπως η παροδική μυελοϋπερπλαστική νόσος σε παιδιά με σύνδρομο Down, προτείνεται παρακολούθηση μόνο (wait and see approach), που επαυξάνει το άγχος των γονιών.
Η πρόγνωση κατά την ηλικία αυτή ποικίλλει, από εξαιρετική με ή χωρίς θεραπεία (νευροβλάστωμα, εξωφυτικό ιεροκοκκυγικό τεράτωμα) έως λίαν επιφυλακτική, όπως σε περιπτώσεις συγγενούς ή βρεφικής λευχαιμίας και ορισμένων όγκων του ΚΝΣ, όπου απαιτείται χημειοθεραπεία ή και ακτινοθεραπεία (σε όγκους ΚΝΣ) με όχι πάντοτε ευνοϊκά αποτελέσματα και με ιδιαίτερα αυξημένη τοξικότητα. Ειδικότερα, αν απαιτηθεί χημειοθεραπεία, πρέπει να χορηγείται με ιδιαίτερη προσοχή και σε δόσεις στις ηλικίες αυτές προσαρμοσμένες ανά χιλιόγραμμο βάρους σώματος και όχι ανά τετραγωνικό μέτρο επιφανείας σώματος που είναι ο συνήθης τρόπος υπολογισμού των δόσεων σε μεγαλύτερα παιδιά.
Abstract
Vasilatou-Kosmidis H. Oncology in infants and neonates. Iatrika Analekta, 2020; 2: 854-861
Tumors in infants and neonates represent only 1.5-2.0% of all childhood tumors and leukemias with an incidence of 1/12,500 to 27,500 live births. As it is known, some tumors are documented during the embryonal life most of which are diagnosed within the first 4 weeks after birth. Approximately 1/5 of all, are associated with various congenital anomalies. There is a moto saying that Òno adult tumor grows as rapidly as a normally dividing embryoÓ. Suspicious for tumor in embryo in the US of the pregnant is the presence of cystic or solid mass, calcifications, bleeding and polyhydramnios. From birth to the age of 3 months the majority of tumors are extracranial teratomas followed by neuroblastoma, leukemias and CNS tumors. In neonates and infants neuroblastoma is the commonest type of cancer whereas leukemia is the prominent type of malignancy in older children. Congenital leukemia, mainly of the acute myelogenous subtype, is diagnosed within the first month of life and is seen in 1/5.000.000 births. In 25%-30% the skin may be involved (leukemia cutis), It bears the 11q23 rearrangement in 85% and the prognosis is very poor. After the first month of life and up to 12 months infantile leukemia is also rare and the prognosis is far worse than this in children beyond one year of life. In 5-10% of neonates with Down syndrome transient myeloproliferative disease-TMD- is diagnosed. This condition starts in intrauterine life, is attributed to abnormal differentiation of megacaryoblasts and regresses after the first three months although in 20% is evoluting to acute megacaryoblastic leukemia. Neuroblastoma is the commonest solid tumor in infants and neonates and is mainly located in the adrenal glands followed by the paraspinal areas. Many of these tumors were found when in utero and most of them regress automatically. Very rarely neuroblastoma in this age group express aggressive behavior with metastatic potential. Adrenal masses in infants <3 months with size <5 cm are followed with ultrasound evaluation. Apart of leukemia and neuroblastoma, various teratomas, CNS tumors and vascular lesions are seen in this age group.
Δεν θα πρέπει να αμελείτε την υγεία σας λόγω της πανδημίας του |